中信建投 | 基因测序产品审批加速,关注行业创新进展

重要提示:通过本订阅号发布的观点和信息仅供中信建投证券股份有限公司(下称“中信建投”)客户中符合《证券期货投资者适当性管理办法》规定的机构类专业投资者参考。因本订阅号暂时无法设置访问限制,若您并非中信建投客户中的机构类专业投资者,为控制投资风险,请您请取消关注,请勿订阅、接收或使用本订阅号中的任何信息。对由此给您造成的不便表示诚挚歉意,感谢您的理解与配合!
文|贺菊颖 刘若飞 赖俊勇
近期基因测序行业审评审批进展较多,世和基因国内首个NGS大Panel通过创新医疗器械特别审查、燃石医学国内首款多癌种早检产品进入创新通道。伴随诊断是目前NGS在肿瘤领域最主要应用场景,此前海外已有多款大Panel获批,后续国内更多企业申报NGS大Panel以及行业标准的逐步完善值得期待。基于NGS的肿瘤早筛潜力巨大,目前海外代表产品Galleri也尚未获批,我们认为后续应关注技术指标进一步优化及更大人群数据的读出。相关产品获批有望带来基因测序行业高速增长,行业创新进展值得关注。

世和基因NGS大Panel获批
10月12日,NMPA批准世和基因旗下南京世和医疗器械有限公司的“非小细胞肺癌组织TMB检测试剂盒(可逆末端终止测序法)”上市。
燃石医学多癌种早期检测产品进入创新通道
10月16日,燃石医学研发的六癌种早期检测产品“人DNA甲基化检测试剂盒(可逆末端终止测序法)”进入NMPA创新医疗器械特别审查程序。

国内首个NGS大Panel获批
近期基因测序行业审评审批进展较多,代表性进展包括世和基因“世和一号”TMB检测试剂盒获批,该产品可通过高通量测序技术检测425个基因并计算肿瘤突变负荷,是国内首款获批上市的NGS大Panel。且该产品是通过创新医疗器械特别审查程序获批的创新医疗器械。10月16日燃石医学公告称六癌种早期检测产品进入NMPA创新医疗器械特别审查程序,是国内首款进入创新通道的多癌种早检产品,后续进展值得期待。
目前NMPA已获批基于NGS的创新器械梳理:
政策沿革:2014年2月,国家食品药品监督管理总局发布《创新医疗器械特别审批程序(试行)》,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用;后续国家药监局于2018年12月修订并发布《创新医疗器械特别审查程序》,符合专利等条件的申请人可申请创新医疗器械特别审查。
已获批产品:截至10月12日世和基因NGS大Panel获批后,目前国家药监局已批准的创新医疗器械共231款,其中基于NGS(高通量测序)的共9款,包括8款测序试剂和1款测序仪器。
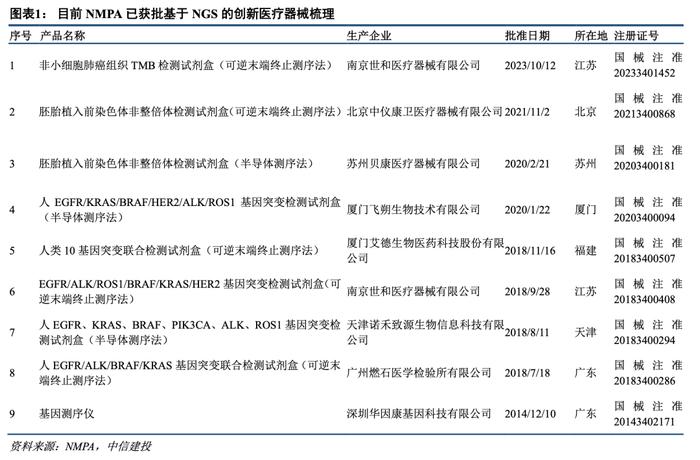
国内首个NGS大Panel获批,行业或将迎来更多创新产品:从此前已获批产品情况来看,2018年燃石医学“人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”获批上市,成为首个获NMPA批准的NGS伴随诊断产品,但此后行业内获批伴随诊断产品检测基因突变数量均未超过10个,即均为小Panel。而在伴随诊断应用中,NGS技术路径相较于荧光PCR通量更高是其主要优势之一,基于NGS的大Panel可同时检测数百个甚至上万个基因。在美国,FDA自2017年起已批准多款基于NGS的大Panel上市,如MSK-IMPACT(2017年获批,468个基因)、FoundationOne CDx(2017年获批,324个基因)等。本次世和基因获批的“非小细胞肺癌组织TMB检测试剂盒(可逆末端终止测序法)”是国内首款基于NGS的大Panel,可通过高通量测序技术检测425个基因并计算肿瘤突变负荷,其通过创新医疗器械特别审查程序表明监管对于国内基因测序领域创新产品的认可。伴随诊断是目前NGS在肿瘤领域最主要应用场景,后续更多企业申报NGS大Panel产品以及行业标准的逐步完善值得期待。
国内首款多癌种早检产品进入创新通道:除世和基因NGS大Panel获批外,10月16日燃石医学六癌种早期检测产品进入NMPA创新医疗器械特别审查程序,是国内首款进入创新通道的多癌种早检产品。该产品基于ELSA-seq技术平台,通过采样外周血测序,同时检测肺癌、肝癌、结直肠癌、卵巢癌、食管癌和胰腺癌六种癌种的信号,并预测信号的来源器官。2023年2月基于ELSA-seq技术的THUNDER临床研究结果发表于Annals of Oncology,在六癌肿早检时特异性98.9%、敏感性69.1%,以及组织溯源准确性83.2%(首要溯源器官)/91.7%(首要及次要溯源器官)。2023年1月份燃石医学基于ELSA-seq技术的多癌种早检产品OverC已获得美国FDA突破性医疗器械认定。
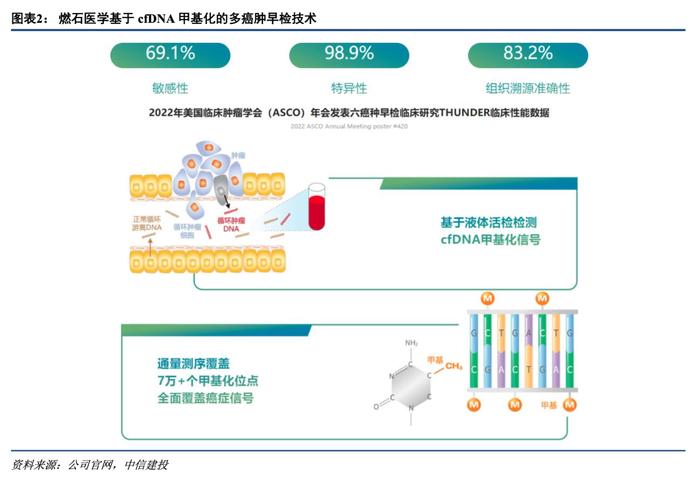
基于NGS的肿瘤早筛潜力巨大,关注技术突破及大人群数据读出:基于NGS的肿瘤早筛早诊目前渗透率仍较低,但未来增长潜力较大,基因测序设备龙头Illumina预计到2027年肿瘤早筛早诊的整体潜在市场(Total Addressable Market)有望达到440亿美元。目前燃石医学的多癌种早检产品海外对标代表产品为Grail公司的Galleri多癌种早检产品,同样基于cfDNA技术路径,可同时检测50种癌症,已完成多项大人群队列研究。从Grail最新公布的PATHFINDER临床研究数据来看,特异性为99.5%、PPV为43.1%,肿瘤信号来源前两位预测预测准确率为97%。目前Galleri在海外也尚未正式获批,我们认为后续应关注技术指标进一步优化及更多大人群数据的读出。相关产品获批有望带来基因测序行业高速增长。

审批政策存在不确定性:临床端使用的基因测序产品通常需要经过监管部门的批准(中国NMPA、美国FDA等),目前在肿瘤早检等领域尚未有基于高通量测序技术产品获批,若未来行业监管政策变化可能导致产品审评审批进度存在不确定性。
对上游供应商依赖风险:基因测序产品及服务提供商处于基因测序产业链中游,其上游为基因测序相关仪器及耗材研发生产企业,整体进入壁垒较高,目前全球代表性企业包括Illumina、华大智造等。中游企业整体议价能力较低,且存在对上游供应商依赖风险。
市场竞争加剧风险:基因组学应用行业发展及更新迭代较快,上游高通量测序等技术升级带来测序成本不断下降,目前中游基因测序产品及服务提供商较多,市场竞争可能加剧。
产品研发及技术发展不及预期:基因测序领域创新产品研发及临床试验结果存在不确定性,目前肿瘤早检等领域大人群队列研究持续推进中,未来存在产品临床结果不及预期甚至研发失败可能。

贺菊颖:中信建投证券医药行业首席分析师,复旦大学管理学硕士,10年以上医药卖方研究从业经验,善于前瞻性把握细分赛道机会,公司研究深入细致,负责整体投资方向判断。2020年度新浪财经金麒麟分析师医药行业第七名、新财富最佳分析师医药行业入围、万德最佳分析师医药行业第四名等荣誉。2019年Wind“金牌分析师”医药行业第1名。2018年Wind“金牌分析师”医药行业第3名,2018第一财经最佳分析师医药行业第1名。2013年新财富医药行业第3名,水晶球医药行业第5名。
刘若飞:医药行业分析师,北京大学生物技术硕士,2017 年加入中信建投证券研究发展部。主要覆盖中药、医药商业、生物制品、医美、CRO 细分领域。2022年(第20届)、2021年(第19届)新财富最佳分析师评选医药生物行业第四名、第五名团队核心成员。2022 年第十六届卖方分析师水晶球奖评选医药生物行业第五名团队核心成员。
赖俊勇:北京大学理学/经济学双学士,北京大学药物化学硕士,以第一作者发表多篇SCI论文。2021年加入中信建投证券研究发展部,主要负责合成生物学、基因测序等板块研究。
证券研究报告名称:《基因测序产品审批加速,关注行业创新进展》
对外发布时间:2023年10月17日
报告发布机构:中信建投证券股份有限公司
本报告分析师:
贺菊颖 SAC 编号:S1440517050001
SFC 编号:ASZ591
刘若飞 SAC 编号:S1440519080003
赖俊勇 SAC 编号:S1440523070007
