君实生物PD-1获FDA批准上市、复宏汉霖 PD-1 单抗达成海外授权、乌帕替尼缓释片两项风湿新适应症在华获批

国产首个PD-1获FDA批准上市
10月27日,君实生物和其合作伙伴Coherus BioSciences宣布,FDA已批准特瑞普利单抗上市,适应症为:1)特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(R/M NPC)患者的一线治疗;2)单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。

鼻咽癌(NPC)是一种罕见肿瘤,在美国,每10万人中有0.5-2例患病,R/M NPC中位平均5年生存率为20%。目前尚无治疗该类肿瘤的免疫疗法获批。特瑞普利单抗联合化疗有望成为鼻咽癌一线治疗的新的标准疗法。
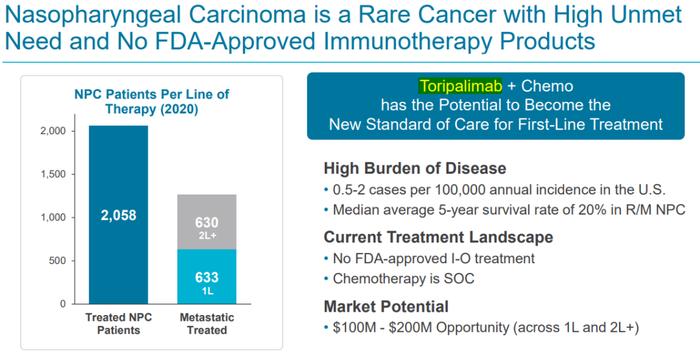
特瑞普利单抗是首个向FDA提交BLA的国产抗PD-1单抗,其BLA申请也曾被FDA授予优先审评。此次批准主要基于POLARIS-02研究(NCT02915432)及JUPITER-02研究(NCT03581786)的数据结果。
POLARIS-02研究是一项多中心、开放标签、II期关键注册临床研究,该研究成果已于2021年1月获《临床肿瘤学杂志》(Journal of Clinical Oncology)在线发表。研究结果显示,特瑞普利单抗表现出持久的抗肿瘤活性和生存获益,安全性可控,且无论患者PD-L1表达如何,均可获益。在92例接受过至少二线系统化疗失败的复发/转移性鼻咽癌患者中,特瑞普利单抗单药治疗的客观缓解率(ORR)为23.9%,中位缓解持续时间(mDOR)达到14.9个月,疾病控制率(DCR)为41.3%,中位总生存时间(mOS)达到15.1个月。
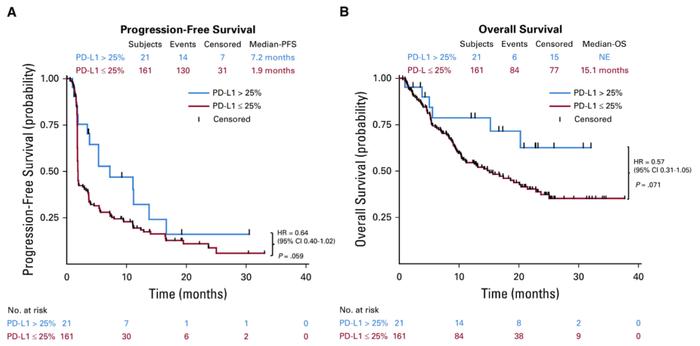
来源:J Clin Oncol. 2021 Mar 1;39(7):704-712.doi: 10.1200/JCO.20.02712. Epub 2021 Jan 25.
JUPITER-02研究是一项随机、双盲、安慰剂对照、国际多中心的III期关键注册临床研究,其研究成果已于2021年9月在《自然-医学》(Nature Medicine)发表。研究结果显示,对于未接受过系统性治疗的复发或转移性NPC患者,与安慰剂联合化疗组相比,特瑞普利单抗联合化疗组中位PFS显著延长,为21.4 vs. 8.2个月,延长13.2个月,并且特瑞普利单抗联合化疗可降低48%的疾病进展或死亡风险(HR=0.52,95%CI:0.37-0.73,双侧p<0.0001)。
2023年ASCO年会上,君实生物公布了JUPITER-02研究最终总生存分析数据,截至2022年11月18日(中位生存随访36.0个月),最终OS和PFS分析结果显示:
与单纯化疗相比,特瑞普利单抗联合化疗一线治疗r/m NPC可显著延长患者OS(两组中位OS分别为 未达到 vs 33.7个月),死亡风险降低37%(HR=0.63, 95%CI:0.45-0.89),P=0.0083。2年OS率和3年OS率分别为78.0% vs 65.1%和64.5% vs 49.2%。
特瑞普利单抗联合化疗组中位PFS显著长于安慰剂联合化疗组,独立评审委员会(BIRC)评估的两组中位PFS分别为21.4 vs. 8.2个月,对比化疗延长13.2个月,疾病进展或死亡风险降低48%(HR=0.52, 95%CI: 0.37-0.73),名义P<0.0001。
此结果为全球首个一线鼻咽癌免疫加化疗对比化疗有统计学预设(一类错误控制)并确认生存获益的III期临床试验,为特瑞普利单抗联合化疗成为新的鼻咽癌一线标准治疗提供了确凿证据。
1.85 亿欧元!复宏汉霖 PD-1 单抗达成海外授权
10 月 27 日,复宏汉霖宣布,与 Intas Pharmaceuticals Limited 达成合作,授予其在欧洲和印度对复宏汉霖自主开发的抗 PD-1 单抗 H 药汉斯状®(斯鲁利单抗)包括广泛期小细胞肺癌(ES-SCLC)在内的多项适应症及特定剂型进行独家开发和商业化的权利。
根据协议,复宏汉霖将负责 H 药在欧洲和印度的临床开发及上市后的产品生产和供应,并将从此次交易中获得 4200 万欧元的首付款、可达 4300 万欧元的监管里程碑付款、可达 1 亿欧元的商业化里程碑付款及两位数比例的合作区域净利润特许权使用费。
至此,斯鲁利单抗的对外授权已经覆盖美国、欧洲、东南亚、中东和北非、印度。在东盟十国和中东和北非地区 12 个国家,斯鲁利单抗的独家开发和商业化权利被授权给 PT Kalbe Genexine Biologics(KGbio);在美国市场,斯鲁利单抗将由复星医药推进商业化合作。
值得一提的是,今年 3 月,斯鲁利单抗一线治疗 ES-SCLC 的上市许可申请已经获欧洲 EMA 受理,有望于 2024 年上半年获得批准;同时在美国,斯鲁利单抗头对头对比一线标准疗法阿替利珠单抗治疗 ES-SCLC 的桥接临床试验已经在稳步推进中,以支持该药在美国的上市申报。
这已经不是复宏汉霖与 Intas 公司的首次合作。2018 年 6 月,复宏汉霖与 Intas 子公司 Accord 展开合作,授予其汉曲优®在欧洲、部分中东及北非地区、部分独联体国家的独家商业化权利,并于 2021 年进一步授予 Intas 汉曲优® 在美国及加拿大地区的独家开发与商业化权利。
经历五年合作,双方已经推动汉曲优® 成功在海外 40 多个国家和地区获批,惠及欧洲、中东和北非等地区患者。
今年上半年,汉曲优® 为复宏汉霖带来了 12.767 亿元销售收入,同比增长 57.1%;在海外市场实现销售及授权许可收入约 0.328 亿元,同比增长 120.1%。斯鲁利单抗则实现销售收入约 5.563 亿元。
乌帕替尼缓释片两项风湿新适应症在华获批
10月27日,艾伯维宣布,药监局已批准乌帕替尼缓释片(商品名:瑞福)用于治疗对非甾体抗炎药(NSAID)应答不佳且存在客观炎症征象(表现为C反应蛋白ICRPT升高和/或磁共振成像IMRI异常)的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)成人患者。
同时,乌帕替尼缓释片还获批用于治疗对一种或多种TNF抑制剂应答不佳或不耐受的活动性强直性脊柱炎(AS)成人患者。此次批准标志着乌帕替尼缓释片成为国内首款且目前唯一覆盖中轴型脊柱关节炎(axSpA)全病程的口服靶向药。
乌帕替尼缓释片治疗nr-axSpA的批准是基于III期SELECT-AXIS 2(研究2)研究的数据支持。该研究评估了瑞福在活动性nr-axSpA成年患者中的疗效、安全性和耐受性。与安慰剂相比,在接受瑞福15mg的患者中,近一半患者在第14周达到ASAS40*应答(主要终点)(分别为44.9%与22.3%)。在接受瑞福治疗的nr-axSpA患者中,早在两周时就观察到了ASAS40应答。
乌帕替尼缓释片AS适应症的获批是基于评估乌帕替尼缓释片治疗对一种或两种生物类缓解病情抗风湿药物(bDMARD)应答不佳或不耐受患者的III期SELECT-AXIS2临床试验(研究1)的疗效和安全性数据的支持。
AxSpA是一种累及脊柱和舐路关节的慢性炎症性风湿疾病包括放射学阴性中轴型脊柱关节炎和放射学阳性中轴型脊柱关节炎,后者又被称为强直性脊柱炎(AS)。国内AS的发病率约为0.3%。Nr-axSpA是一种慢性、进展性炎症性风湿病,可引起关节炎症,导致背痛和僵硬,且不能通过X线检查发现。而AS是一种主要累及脊柱的慢性炎症性肌肉骨骼疾病,以炎症性背痛、僵硬和活动受限等症状为特征。据估计,10-40%的nr-axSpA患者将在2-10年进展为AS。
乌帕替尼缓释片是一种选择性JAK抑制剂,目前正在数种免疫介导性疾病中进行研究。研究表明,乌帕替尼对JAK1的抑制效力大于对JAK2、JAK3和TYK2的抑制效力。
此前,乌帕替尼缓释片15mg已获药监局批准用于治疗对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎的12岁及以上的成人和儿童患者;用于治疗对一种或多种TNF抑制剂应答不佳或不耐受的中度至重度活动性类风湿关节炎成人患者;用于治疗对一种或多种DMARD应答不佳或不耐受的成年患者的活动性银屑病关节炎;用于治疗对一种或多种肿瘤坏死因子(TNF)抑制剂应答不佳或不耐受或禁忌的中度至重度活动性溃疡性结肠炎(UC)成人患者以及对一种或多种肿瘤坏死因子(TNF)抑制剂应答不佳或不耐受或禁忌的中度至重度活动性克罗恩病成人患者。
编辑:郑淼
