海思科镇痛新药新适应症获批临床,将在澳大利亚设立子公司

转自:一度医药
1月30日,海思科发布公告,其1类新药HSK16149胶囊新适应症已获国家药品监督管理局受理,拟用于治疗纤维肌痛。

(公告)
HSK16149属于口服GABA类似物,是一种电压门控钙离子通道类新型镇痛药,可以与钙离子通道α2δ亚受体结合,具备高靶点选择性、强效镇痛、长效镇痛、中枢副作用小等特点,对中至重度患者疗效可能更佳。
纤维肌痛(fibromyalgia,FM)又称为纤维肌痛综合征,是一种中枢神经感觉传入处理功能失调引起的慢性弥漫性疼痛综合征,其主要症状包括多部位疼痛、重度疲乏、僵硬感、睡眠障碍、认知障碍以及心理问题。疼痛是FM最突出的临床表现。FM常与其他系统性疾病合并存在,对病人生活质量造成严重影响。
与HSK16149同机制的镇痛药物普瑞巴林也是美国食品药品管理局(FDA)推荐的 FM 一线治疗药物,其在国内也已经获批准治疗FM。而相比于普瑞巴林,HSK16149与α2δ亚受体结合力更强,预期止痛疗效更好,有望为纤维肌痛的治疗提供安全有效的新选择。
值得一提的是,HSK16149的另一项新适应也才刚在几天前(1月11日)获批临床,用于中枢神经病理性疼痛。
截止目前,海思科开展了HSK16149的10项临床试验,皆已完成,适应症包括糖尿病周围神经痛(DPNP)、带状疱疹后神经痛(PHN)、骨科围手术期镇痛、周围神经痛。
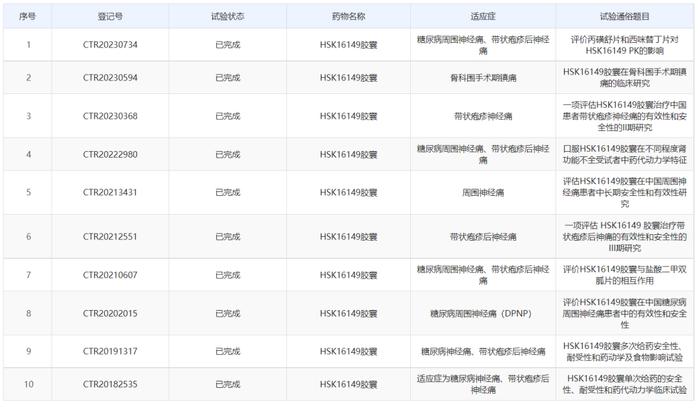
图源:chinadrugtrials
2022年10月,海思科递交了HSK16149的第一项适应症的上市申请,用于治疗糖尿病周围神经痛。
去年9月,海思科递交了HSK16149的第二项适应症的上市申请,用于带状疱疹后遗神经痛。
HSK16149有望在今年获批第一项适应症。
同日,海思科还发布公告称,拟以自有资金 5 万澳元在澳大利亚出资设立全资子公司HAISCO INNOVATIVE PHARMACEUTICAL (AUSTRALIA) PTY LTD.,以推进进公司产品在海外的临床研究,加快产品的国际化进程,进一步提升公司核心竞争力。

(公告)
截止目前,海思科在美国、亚洲和澳大利亚拥有7家全资子公司,海外有10余个研发合作项目。在美国新泽西州设立Haisco-USA Pharmaceuticals lnc,主要负责创新药产品在美国的临床开发。
其中,海思科首款商业化创新药环泊酚注射液(商品名:思舒宁)已在美国完成三项临床研究,预计将在今年底向FDA递交NDA。
环泊酚注射液于2020年在中国上市,陆续获批用于非气管插管手术/操作中的镇静和麻醉、全身麻醉诱导和维持和重症监护期间机械通气时的镇静。是中国首个自主化合物创新1类静脉麻醉药,填补该领域近40年无法超越丙泊酚的空白。
去年,海思科的1类创新药HSK31858片还成功出海授权意大利Chiesi集团,交易金额最高合计4.62亿美元,其中首付款1300万美元。
海思科正在加速全球布局。
参考资料:
企业公告
